
H18 EIWITTEN
Je kan uitleggen hoe de aminozuurvolgorde (primaire structuur) van een eiwit de bouw en werking van het eiwit bepaalt (****BINAS 67H):
Aminozuren worden aan elkaar gekoppeld met een peptidebinding; de type aminozuren en de volgorde bepalen de primaire structuur van een eiwit. Deze primaire structuur wordt in bepaalde vormen gevouwen door waterstofbruggen, zwavelbruggen (heel sterk), ionbindingen en van der waals-bindingen: het resultaat is de secundaire structuur (alfa-helix of betasheet). De tertiaire structuur is een 3D-structuur als resultaat van bindingen van de restgroepen. De quartenaire structuur ontstaat wanneer meerdere polypeptideketens in elkaar gevouwen zijn.
Je leert hoe een cel van 1 of meer polypeptideketens een werkzaam eiwit maakt (****BINAS 71J):
Om eiwitten naar de juiste plek te brengen, krijgen ze een adreslabel mee tijdens hun vorming; dit is het eerst gevormde stukje polypeptideketen. Zie hierbij de afbeelding in BINAS 71J:
Een signaal-herkenningsmolecuul hecht aan het adreslabel en blokkeert tijdelijk de translatie → SHM bindt aan een SHM-receptor; het ribosoom hecht aan de receptor op het ER → GTP bindt aan SHM en de receptor; het hierbij horende eiwitpoortje opent; de polypeptideketen komt in het ER → GTP (nu GDP + Pi) heeft zijn energie afgegeven en SHM komt weer vrij → een enzym knipt het adreslabel los; de translatie gaat verder; de groeiende polypeptideketen komt in het ER terecht → de voltooide polypeptideketen komt los in het ER; het ribosoom komt vrij van de SHM-receptor en het eiwitpoortje sluit.
In het endoplastisch reticulum krijgt een polypeptideketen een eiwitstructuur en toevoegingen (bijv. koolhydraten). Stukjes membraan van glad ER vormen transportblaasjes die de eiwitten naar het Golgi-systeem vervoeren. In het Golgi-systeem ontstaat de definitieve eindvorm; fosfaatgroepen worden toegevoegd; meerdere polypeptideketens worden aaneen gekoppeld tot één eiwit; de eiwitten krijgen een adreslabel mee. Door exocytose worden de eiwitten buiten de cel afgegeven.
Je kan beschrijven op welke wijze enzymen reacties katalyseren en hoe de temperatuur en pH deze beïnvloeden:
Enzymen zijn eiwitten die chemische reacties mogelijk maken. Enzymen zijn biokatalysatoren: ze worden gebruikt maar niet verbruikt. De tertiaire structuur van een enzym is bepalend voor de werking; als de vorm verandert verliest het zijn werking. Elk enzym is substraatspecifiek.
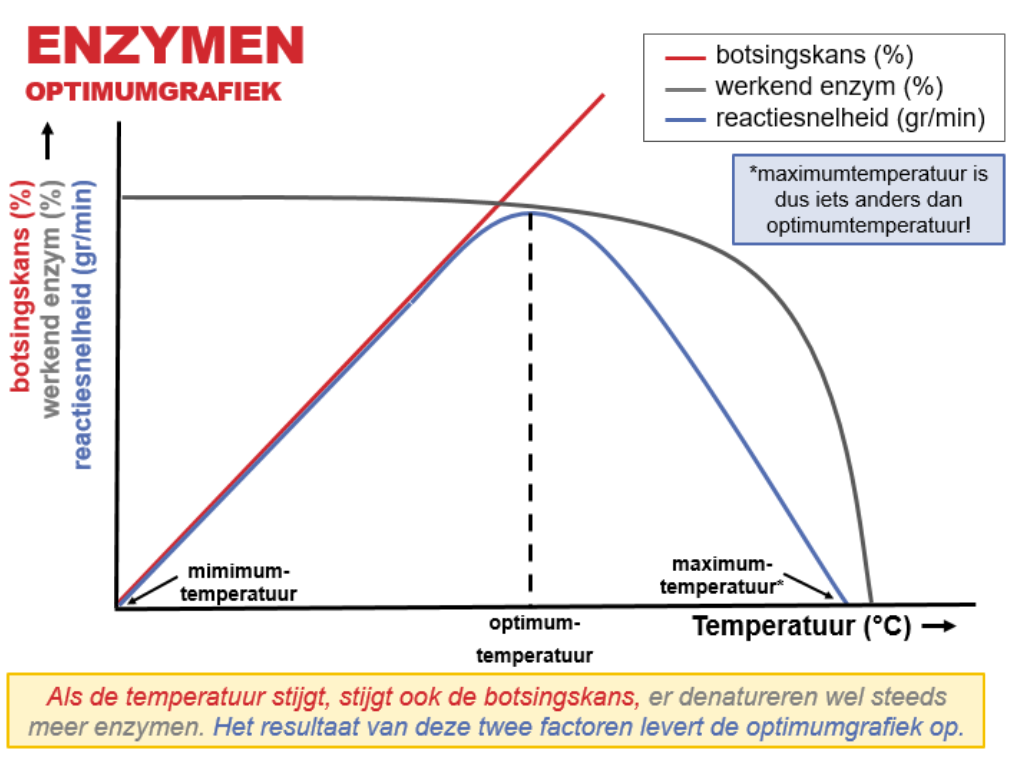
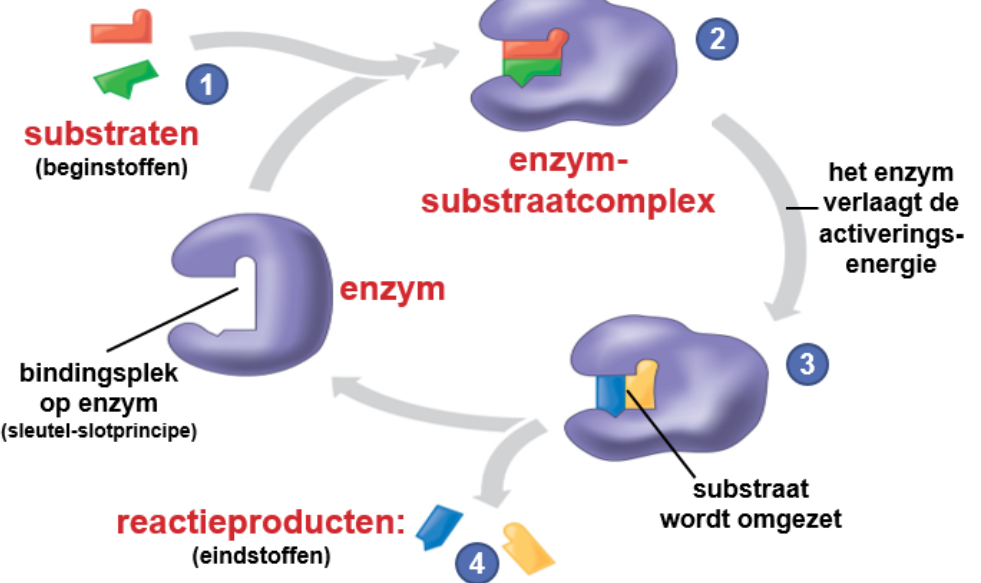 Denaturatie is de permanente verandering van de structuur van een eiwit, dit kan door een te hoge temperatuur of een verandering van de pH.
Denaturatie is de permanente verandering van de structuur van een eiwit, dit kan door een te hoge temperatuur of een verandering van de pH.
 Je leert op welke manier cellen de activiteit van enzymen regelen:
Je leert op welke manier cellen de activiteit van enzymen regelen:
Bij het actieve centrum kunnen hulpstoffen voorkomen, dit zijn de co-enzymen (organisch) en de cofactoren (anorganisch). Deze hulpstoffen zorgen ervoor dat een substraat kan binden.
Enkele enzymen hebben naast het actieve centrum, een allosterisch centrum. Hierdoor kan de structuur van het eiwit veranderen; dit kan een positief of een negatief effect hebben. Wanneer een stof op de allosterische zijde bindt en er zo voor zorgt dat het substraat niet meer kan binden, heet dit allosterische remming.
Eindproductremming: het eindproduct van een reactieketen remt via allosterische remming het eerste enzym in de keten.
Wanneer een stof op de actieve plaats bindt en er zo voor zorgt dat het substraat niet kan binden, heet dit competitieve remming.
Je leert hoe een cel eiwitten opruimt en hoe de cel voorkomt dat er ongewenste eiwitten ontstaan (****BINAS 71K):
RNAi kan de aanmaak van bepaalde eiwitten tegengaan. Er zijn twee typen RNAi:
miRNA: wordt door cel zelf gemaakt
siRNA: virus-RNA of synthetisch-RNA wordt gebruikt; hierdoor kan een gen kunstmatig (tijdelijk) worden uitgeschakeld.
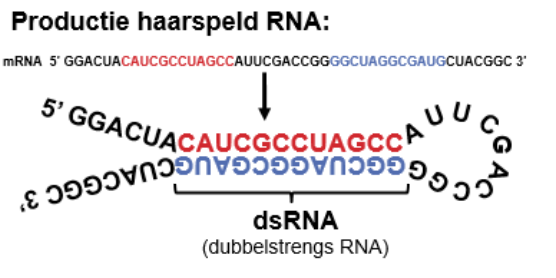
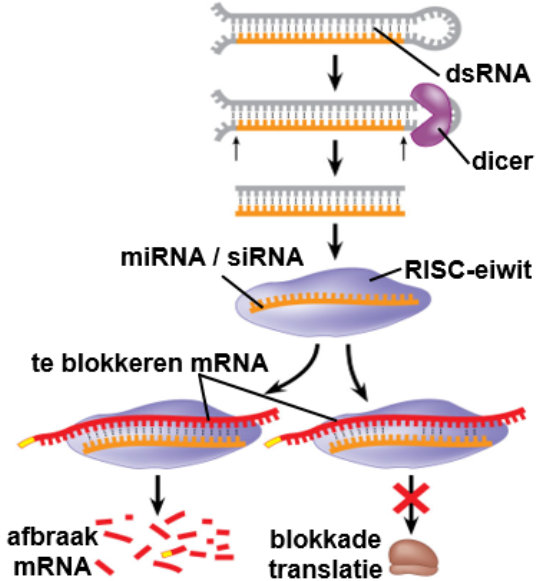 Cellen gebruiken RNA-interferentie als afweermechanisme tegen RNA-virussen.
Cellen gebruiken RNA-interferentie als afweermechanisme tegen RNA-virussen.
Een proteasoom breekt de peptidebindingen in verouderde en fout gemaakte eiwitten af. Het eiwit ubiquitine werkt als merkteken.
Je leert hoe je het eiwitprofiel van een cel kunt maken:
DNA-microarray is een techniek die laat zien welke genen actief zijn in een cel.
Isolatie van mRNA uit weefsel
Reverse transcriptase gebruikt mRNA om cDNA (complement DNA, dus zonder introns) te maken.
Verwijderen met RNase van het mRNA; enkelstrengs DNA blijft over (matrijsstreng, zonder introns).
cDNA wordt op een microarray geplaatst, waarbij in elke spot een complementaire sequentie aanwezig is van een bepaald gen; het cDNA kan hieraan binden. Spots waar hechting heeft plaatsgevonden kleuren in het laserlicht.
Je kan met behulp van bron 25 (blz. 71) beschrijven hoe CRISPR-cas genetische modificatie mogelijk maakt:
Archaea hebben een afweermechanisme tegen virussen, (bacterio)fagen: namelijk CRISPR-Cas. Fagen kennen een lysogene cyclus, waarbij de bacterie in leven blijft. Het faag-DNA integreert met het bacteriële DNA: het heet dan profaag-DNA. Bij de lytische cyclus breekt het virus het bacteriële DNA af en gaat de gastheercel dood.
Een gedeelte van het bacteriële DNA, het CRISPR-locus bestaat uit herhalingen van bacterie-DNA met daar tussen spacer DNA: stukjes van fagen die ooit de bacterie (of de voorouders) hebben geïnfecteerd. De Cas-genen coderen voor de enzymen helicase en het nuclease Cas9 (knipt DNA). De bacterie maakt een RNA-kopie van een CRISPR-repeat en het bijbehorende spacer-DNA: het gids-RNA. Dit koppelt aan een Cas9-eiwit → CRISPR-Cas9-eiwit. Wordt virus-DNA ‘herkend’ splitst Cas-helicase het virus-DNA open en knipt Cas-nuclease het in stukjes.
Toepassing: een knock-outgen wordt gebruikt om aan te geven dat een gen volledig uit het genoom is weggehaald of onbruikbaar is gemaakt: zo kan de genfunctie worden bepaald.
Je kan beschrijven dat plasmiden (bron 5, blz. 134) gebruikt kan worden om een nieuw gen een cel in te brengen (****BINAS 71M1):
Genetische modificatie: een organisme krijgt een gewenst gen in zijn genoom ingebouwd m.b.v een vector (een virus of plasmide).
Cisgeen: organisme krijgt eigenschap van soortgenoot
Transgeen: organisme krijgt eigenschap van een niet-soortgenoot.
Een plasmide is een cirkelvormige streng DNA die zich buiten het chromosoom bevindt van eencellige organismen. Dit kan gebruikt worden als vector.
De plasmide is uit de bacterie verwijderd; een restrictie-enzym knipt het vervolgens open.
Eenzelfde enzym knipt het gewenste gen uit het DNA van een donororganisme.
Het gewenste gen is overgebracht naar de plasmide.
De plasmide is teruggebracht in een bacterie.
De bacteriën met het gewenste gen worden geïsoleerd met behulp van een markergen: bijvoorbeeld een gen dat codeert voor resistentie tegen een antibioticum.
Via de bacterie komt het gen in een chromosoom van een plantencel.
Er ontstaat een plant met nieuwe, gewenste eigenschap.
H18 EIWITTEN
Je kan uitleggen hoe de aminozuurvolgorde (primaire structuur) van een eiwit de bouw en werking van het eiwit bepaalt (****BINAS 67H):
Aminozuren worden aan elkaar gekoppeld met een peptidebinding; de type aminozuren en de volgorde bepalen de primaire structuur van een eiwit. Deze primaire structuur wordt in bepaalde vormen gevouwen door waterstofbruggen, zwavelbruggen (heel sterk), ionbindingen en van der waals-bindingen: het resultaat is de secundaire structuur (alfa-helix of betasheet). De tertiaire structuur is een 3D-structuur als resultaat van bindingen van de restgroepen. De quartenaire structuur ontstaat wanneer meerdere polypeptideketens in elkaar gevouwen zijn.
Je leert hoe een cel van 1 of meer polypeptideketens een werkzaam eiwit maakt (****BINAS 71J):
Om eiwitten naar de juiste plek te brengen, krijgen ze een adreslabel mee tijdens hun vorming; dit is het eerst gevormde stukje polypeptideketen. Zie hierbij de afbeelding in BINAS 71J:
Een signaal-herkenningsmolecuul hecht aan het adreslabel en blokkeert tijdelijk de translatie → SHM bindt aan een SHM-receptor; het ribosoom hecht aan de receptor op het ER → GTP bindt aan SHM en de receptor; het hierbij horende eiwitpoortje opent; de polypeptideketen komt in het ER → GTP (nu GDP + Pi) heeft zijn energie afgegeven en SHM komt weer vrij → een enzym knipt het adreslabel los; de translatie gaat verder; de groeiende polypeptideketen komt in het ER terecht → de voltooide polypeptideketen komt los in het ER; het ribosoom komt vrij van de SHM-receptor en het eiwitpoortje sluit.
In het endoplastisch reticulum krijgt een polypeptideketen een eiwitstructuur en toevoegingen (bijv. koolhydraten). Stukjes membraan van glad ER vormen transportblaasjes die de eiwitten naar het Golgi-systeem vervoeren. In het Golgi-systeem ontstaat de definitieve eindvorm; fosfaatgroepen worden toegevoegd; meerdere polypeptideketens worden aaneen gekoppeld tot één eiwit; de eiwitten krijgen een adreslabel mee. Door exocytose worden de eiwitten buiten de cel afgegeven.
Je kan beschrijven op welke wijze enzymen reacties katalyseren en hoe de temperatuur en pH deze beïnvloeden:
Enzymen zijn eiwitten die chemische reacties mogelijk maken. Enzymen zijn biokatalysatoren: ze worden gebruikt maar niet verbruikt. De tertiaire structuur van een enzym is bepalend voor de werking; als de vorm verandert verliest het zijn werking. Elk enzym is substraatspecifiek.
 Denaturatie is de permanente verandering van de structuur van een eiwit, dit kan door een te hoge temperatuur of een verandering van de pH.
Denaturatie is de permanente verandering van de structuur van een eiwit, dit kan door een te hoge temperatuur of een verandering van de pH.
 Je leert op welke manier cellen de activiteit van enzymen regelen:
Je leert op welke manier cellen de activiteit van enzymen regelen:
Bij het actieve centrum kunnen hulpstoffen voorkomen, dit zijn de co-enzymen (organisch) en de cofactoren (anorganisch). Deze hulpstoffen zorgen ervoor dat een substraat kan binden.
Enkele enzymen hebben naast het actieve centrum, een allosterisch centrum. Hierdoor kan de structuur van het eiwit veranderen; dit kan een positief of een negatief effect hebben. Wanneer een stof op de allosterische zijde bindt en er zo voor zorgt dat het substraat niet meer kan binden, heet dit allosterische remming.
Eindproductremming: het eindproduct van een reactieketen remt via allosterische remming het eerste enzym in de keten.
Wanneer een stof op de actieve plaats bindt en er zo voor zorgt dat het substraat niet kan binden, heet dit competitieve remming.
Je leert hoe een cel eiwitten opruimt en hoe de cel voorkomt dat er ongewenste eiwitten ontstaan (****BINAS 71K):
RNAi kan de aanmaak van bepaalde eiwitten tegengaan. Er zijn twee typen RNAi:
miRNA: wordt door cel zelf gemaakt
siRNA: virus-RNA of synthetisch-RNA wordt gebruikt; hierdoor kan een gen kunstmatig (tijdelijk) worden uitgeschakeld.

 Cellen gebruiken RNA-interferentie als afweermechanisme tegen RNA-virussen.
Cellen gebruiken RNA-interferentie als afweermechanisme tegen RNA-virussen.
Een proteasoom breekt de peptidebindingen in verouderde en fout gemaakte eiwitten af. Het eiwit ubiquitine werkt als merkteken.
Je leert hoe je het eiwitprofiel van een cel kunt maken:
DNA-microarray is een techniek die laat zien welke genen actief zijn in een cel.
Isolatie van mRNA uit weefsel
Reverse transcriptase gebruikt mRNA om cDNA (complement DNA, dus zonder introns) te maken.
Verwijderen met RNase van het mRNA; enkelstrengs DNA blijft over (matrijsstreng, zonder introns).
cDNA wordt op een microarray geplaatst, waarbij in elke spot een complementaire sequentie aanwezig is van een bepaald gen; het cDNA kan hieraan binden. Spots waar hechting heeft plaatsgevonden kleuren in het laserlicht.
Je kan met behulp van bron 25 (blz. 71) beschrijven hoe CRISPR-cas genetische modificatie mogelijk maakt:
Archaea hebben een afweermechanisme tegen virussen, (bacterio)fagen: namelijk CRISPR-Cas. Fagen kennen een lysogene cyclus, waarbij de bacterie in leven blijft. Het faag-DNA integreert met het bacteriële DNA: het heet dan profaag-DNA. Bij de lytische cyclus breekt het virus het bacteriële DNA af en gaat de gastheercel dood.
Een gedeelte van het bacteriële DNA, het CRISPR-locus bestaat uit herhalingen van bacterie-DNA met daar tussen spacer DNA: stukjes van fagen die ooit de bacterie (of de voorouders) hebben geïnfecteerd. De Cas-genen coderen voor de enzymen helicase en het nuclease Cas9 (knipt DNA). De bacterie maakt een RNA-kopie van een CRISPR-repeat en het bijbehorende spacer-DNA: het gids-RNA. Dit koppelt aan een Cas9-eiwit → CRISPR-Cas9-eiwit. Wordt virus-DNA ‘herkend’ splitst Cas-helicase het virus-DNA open en knipt Cas-nuclease het in stukjes.
Toepassing: een knock-outgen wordt gebruikt om aan te geven dat een gen volledig uit het genoom is weggehaald of onbruikbaar is gemaakt: zo kan de genfunctie worden bepaald.
Je kan beschrijven dat plasmiden (bron 5, blz. 134) gebruikt kan worden om een nieuw gen een cel in te brengen (****BINAS 71M1):
Genetische modificatie: een organisme krijgt een gewenst gen in zijn genoom ingebouwd m.b.v een vector (een virus of plasmide).
Cisgeen: organisme krijgt eigenschap van soortgenoot
Transgeen: organisme krijgt eigenschap van een niet-soortgenoot.
Een plasmide is een cirkelvormige streng DNA die zich buiten het chromosoom bevindt van eencellige organismen. Dit kan gebruikt worden als vector.
De plasmide is uit de bacterie verwijderd; een restrictie-enzym knipt het vervolgens open.
Eenzelfde enzym knipt het gewenste gen uit het DNA van een donororganisme.
Het gewenste gen is overgebracht naar de plasmide.
De plasmide is teruggebracht in een bacterie.
De bacteriën met het gewenste gen worden geïsoleerd met behulp van een markergen: bijvoorbeeld een gen dat codeert voor resistentie tegen een antibioticum.
Via de bacterie komt het gen in een chromosoom van een plantencel.
Er ontstaat een plant met nieuwe, gewenste eigenschap.
 Knowt
Knowt