
Chemie : Samevatting
Vorig schooljaar:
reactievergelijkingen in evenwicht stellen (balanceren)
Ionbinding en covalente binding kunnen uitwerken(herhaling vorig jaar)
Elementen en hun symbolen: https://knowt.io/flashcards/fffc092a-6aff-40cd-81bc-cf7735eee90c
Hoofdstuk 1:
Metaal hydroxide = Metaal + Waterstof + Zuurstof
Zuren:
Binaire zuren = Niet Metaal + Waterstof
Oxozuren = Waterstof + Niet Metaal + Zuurstaf
Pseudobinaire zuren = HCN (Deze doen als of ze zuren zijn door dat de koolstof en het stikstof zo dicht bij elkaar zijn.
Zouten = Metaal + zuurrest
Niet-zouten = Niet Metaal + Niet metaal
Naamgeving Anorganisch matriaal:
Telnumer
1 | mono | 6 | hex |
|---|---|---|---|
2 | di | 7 | hept |
3 | tri | 8 | octa |
4 | tetra | 9 | nona |
5 | penta | 10 | deca |
Hoofdstuk 2:
Absolute atoommassa.
Het absolute gewicht van een atoom in kilogram
Bijvoorbeeld: 1 atoom waterstof weegt 0,000 000 000 000 000 000 000 000 00167 kg of 1,67.10^-27 kg
Relatieve atoommassa (Ar).
De atoommassa op basis van een waterstof atoom. Hier bij is het gewicht van een waterstof atoom de eenheid dus heb je geen super klein getal dit is ook gelijk aan de molaire massa.
Relatieve moleculemassa.
De massa van een moleculen gedeeld door de massa van een waterstof atoom
Hoofdstuk 3:
N(A) = 6,02.10^23
N = n x N(A)
n = De hoeveelheid mol
N(A) = mol
N = molaire massa
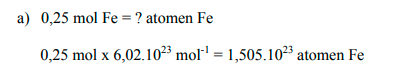
massa = aantal mol x molaire massa
m = n x M
ALLEEN BIJ GASSEN
n = V/ Vm
Vm = 22,4l/mol
V = volume
Dit is N.O. (normale omstandigheden)
Chemie : Samevatting
Vorig schooljaar:
reactievergelijkingen in evenwicht stellen (balanceren)
Ionbinding en covalente binding kunnen uitwerken(herhaling vorig jaar)
Elementen en hun symbolen: https://knowt.io/flashcards/fffc092a-6aff-40cd-81bc-cf7735eee90c
Hoofdstuk 1:
Metaal hydroxide = Metaal + Waterstof + Zuurstof
Zuren:
Binaire zuren = Niet Metaal + Waterstof
Oxozuren = Waterstof + Niet Metaal + Zuurstaf
Pseudobinaire zuren = HCN (Deze doen als of ze zuren zijn door dat de koolstof en het stikstof zo dicht bij elkaar zijn.
Zouten = Metaal + zuurrest
Niet-zouten = Niet Metaal + Niet metaal
Naamgeving Anorganisch matriaal:
Telnumer
1 | mono | 6 | hex |
|---|---|---|---|
2 | di | 7 | hept |
3 | tri | 8 | octa |
4 | tetra | 9 | nona |
5 | penta | 10 | deca |
Hoofdstuk 2:
Absolute atoommassa.
Het absolute gewicht van een atoom in kilogram
Bijvoorbeeld: 1 atoom waterstof weegt 0,000 000 000 000 000 000 000 000 00167 kg of 1,67.10^-27 kg
Relatieve atoommassa (Ar).
De atoommassa op basis van een waterstof atoom. Hier bij is het gewicht van een waterstof atoom de eenheid dus heb je geen super klein getal dit is ook gelijk aan de molaire massa.
Relatieve moleculemassa.
De massa van een moleculen gedeeld door de massa van een waterstof atoom
Hoofdstuk 3:
N(A) = 6,02.10^23
N = n x N(A)
n = De hoeveelheid mol
N(A) = mol
N = molaire massa
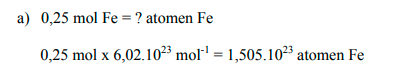
massa = aantal mol x molaire massa
m = n x M
ALLEEN BIJ GASSEN
n = V/ Vm
Vm = 22,4l/mol
V = volume
Dit is N.O. (normale omstandigheden)
 Knowt
Knowt