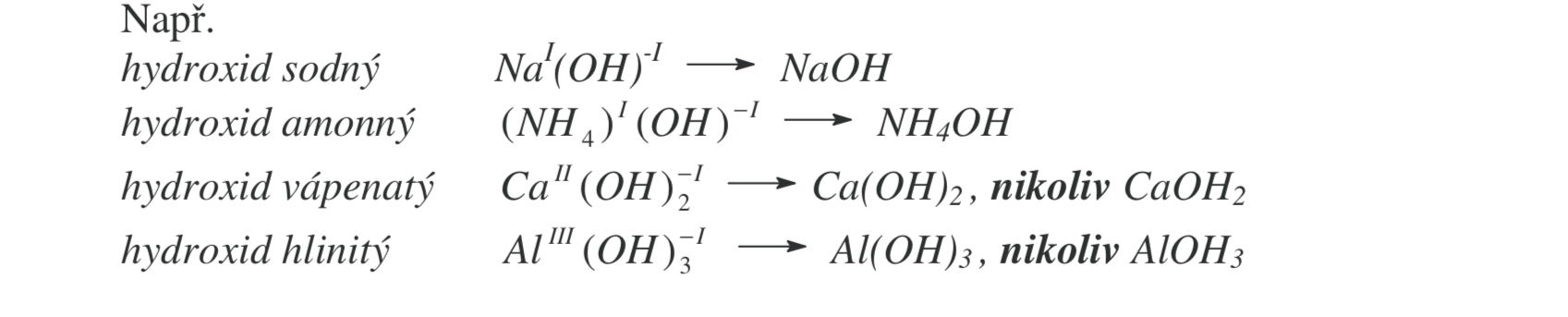Názvosloví
Obsah:
Názvosloví
K zapamatování
oxidů
Hydroxidů
Kyselin
Bezkyslíkaté kyseliny
Kyslíkaté kyseliny
Polykyseliny
Hydrogenkyseliny
Thiokyseliny
Solí
Soli bezkyslíkatých kyselin
Soli kyslíkatých kyselin
hydrogensoli
Hydráty
Podvojné soli

NH3 = amoniak
PH3 = fosfan
ASH3 = arsan
CH4 = methan
SiH4 = silan
BH3 = boran
H2SO4 = kyselina sírová
H2SO3 = kyselina siřičitá
H2CO3 = kyselina uhličitá
Názvosloví oxidů
Binární (dvouprvkové) sloučeniny s kyslíkem
Oxidační číslo kyslíku je -2
Tvoření vzorce
Oxid dusičný - ičný=5
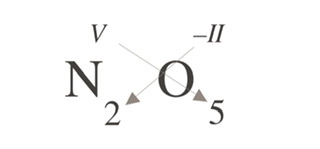
křížové pravidlo
Název tvořed slovem oxid + přídavným jménem odvozeným od prvku
Názvosloví hydroxidů
mají skupinu -OH (oxidační číslo -1)
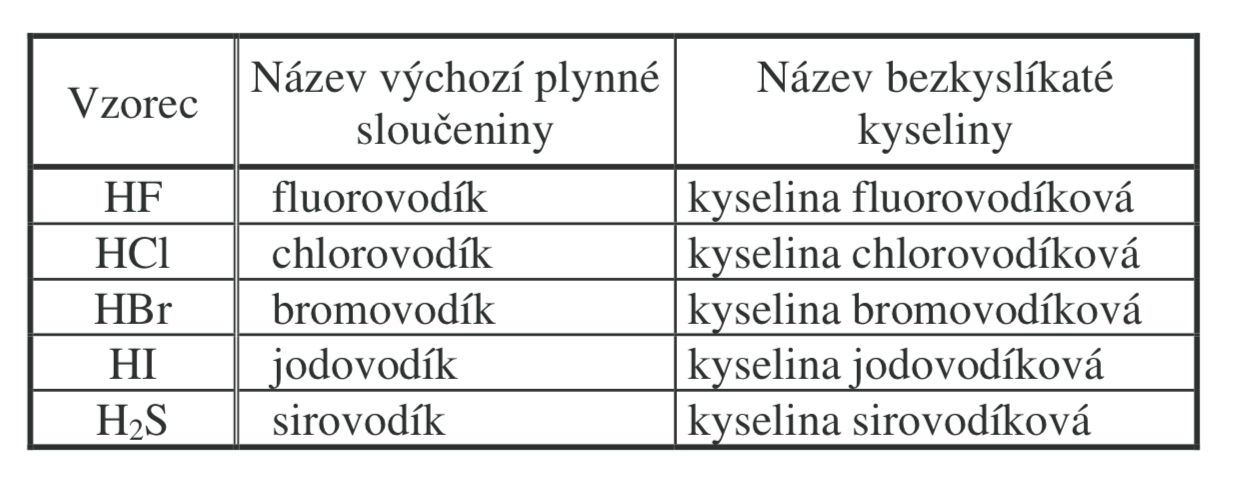
Bezkyslíkaté kyseliny
H má oxidační číslo +1
Kyslíkaté kyseliny
většinou tříprvkové sloučeniny (H, další prvek, O)
Oxidační čísla H + prvek X = O

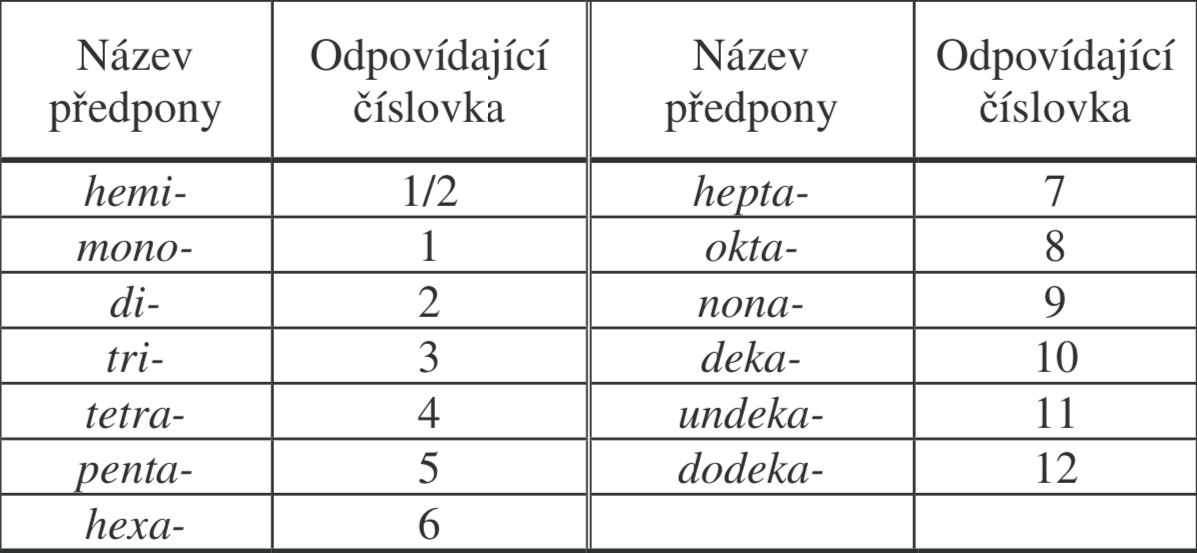
Polykyseliny
více centrálních atomů
Zapamatovat:
Např.
Kyselina tetrakřemičitá - má 4 x křemík
Hydrogenkyseliny
Má víc vodíků
Např. Trihydrogen fosforitá
Thiokyseliny
kyslík nahrazen sírou
Soli bezkyslíkatých kyselin
Nemají kyslík

Tvoření názvu
Podstatným jménem odvozeným od aiontu + koncovka -id (jodid, bromid)
Přídavným jménem odvozeným od názvu prvku se zakončením podle oxidačního čísla
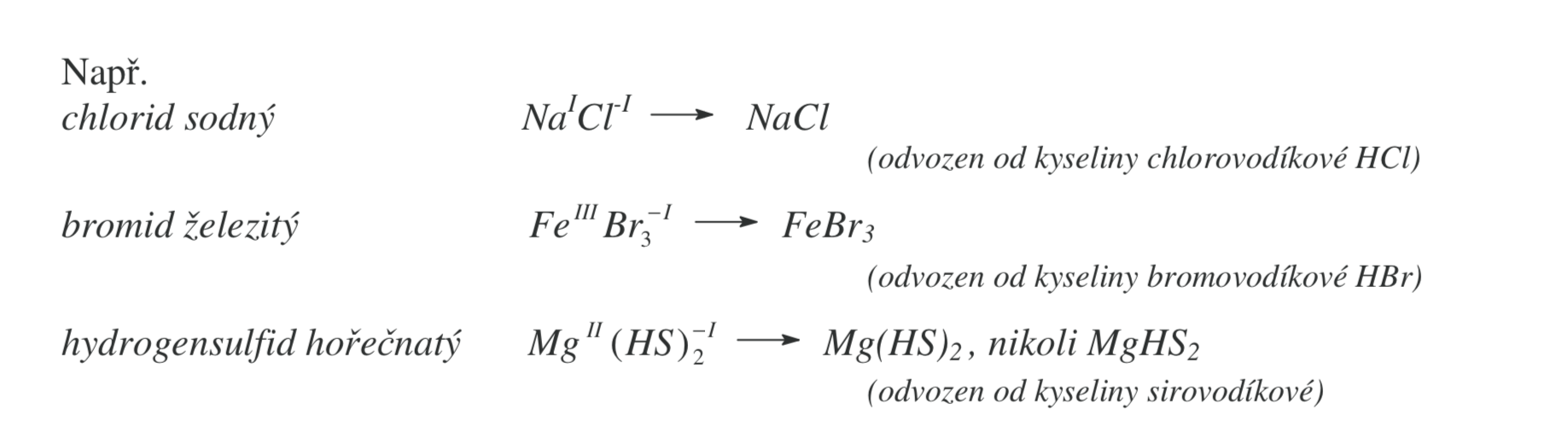 Soli kyslíkatých kyselin
Soli kyslíkatých kyselin
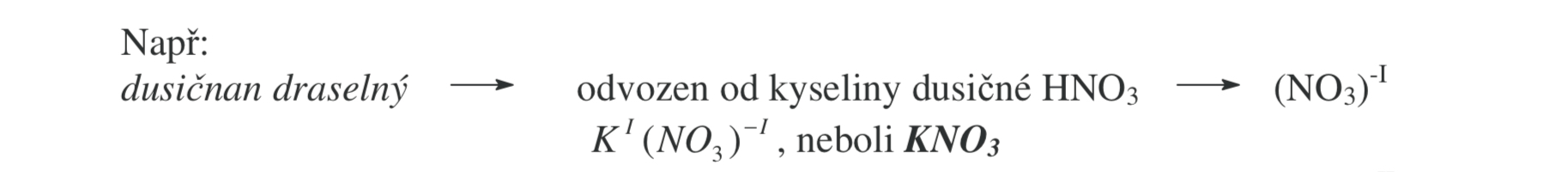
 Hydrogensoli
Hydrogensoli
vzniká, pokud nejsou nahrazeny všechny vodíky
Počet nenahrazených vodíků je vyjádřen před slovem hydrogen (dihydrogen, tetrahydrogen,…)
 Hydráty
HydrátySoli obsahující vázané molekuly vody
 Podvojné soli
Podvojné soli
Obsahují dva anionty nebo dva kationty
Kationty se řadí podle vzrůstající hodnoty oxidačního čísla
Anionty se řadí abecedně


Názvosloví
Obsah:
Názvosloví
K zapamatování
oxidů
Hydroxidů
Kyselin
Bezkyslíkaté kyseliny
Kyslíkaté kyseliny
Polykyseliny
Hydrogenkyseliny
Thiokyseliny
Solí
Soli bezkyslíkatých kyselin
Soli kyslíkatých kyselin
hydrogensoli
Hydráty
Podvojné soli

NH3 = amoniak
PH3 = fosfan
ASH3 = arsan
CH4 = methan
SiH4 = silan
BH3 = boran
H2SO4 = kyselina sírová
H2SO3 = kyselina siřičitá
H2CO3 = kyselina uhličitá
Názvosloví oxidů
Binární (dvouprvkové) sloučeniny s kyslíkem
Oxidační číslo kyslíku je -2
Tvoření vzorce
Oxid dusičný - ičný=5

křížové pravidlo
Název tvořed slovem oxid + přídavným jménem odvozeným od prvku
Názvosloví hydroxidů
mají skupinu -OH (oxidační číslo -1)
Bezkyslíkaté kyseliny
H má oxidační číslo +1
Kyslíkaté kyseliny
většinou tříprvkové sloučeniny (H, další prvek, O)
Oxidační čísla H + prvek X = O

Polykyseliny
více centrálních atomů
Zapamatovat:

Např.
Kyselina tetrakřemičitá - má 4 x křemík
Hydrogenkyseliny
Má víc vodíků
Např. Trihydrogen fosforitá
Thiokyseliny
kyslík nahrazen sírou
Soli bezkyslíkatých kyselin
Nemají kyslík

Tvoření názvu
Podstatným jménem odvozeným od aiontu + koncovka -id (jodid, bromid)
Přídavným jménem odvozeným od názvu prvku se zakončením podle oxidačního čísla
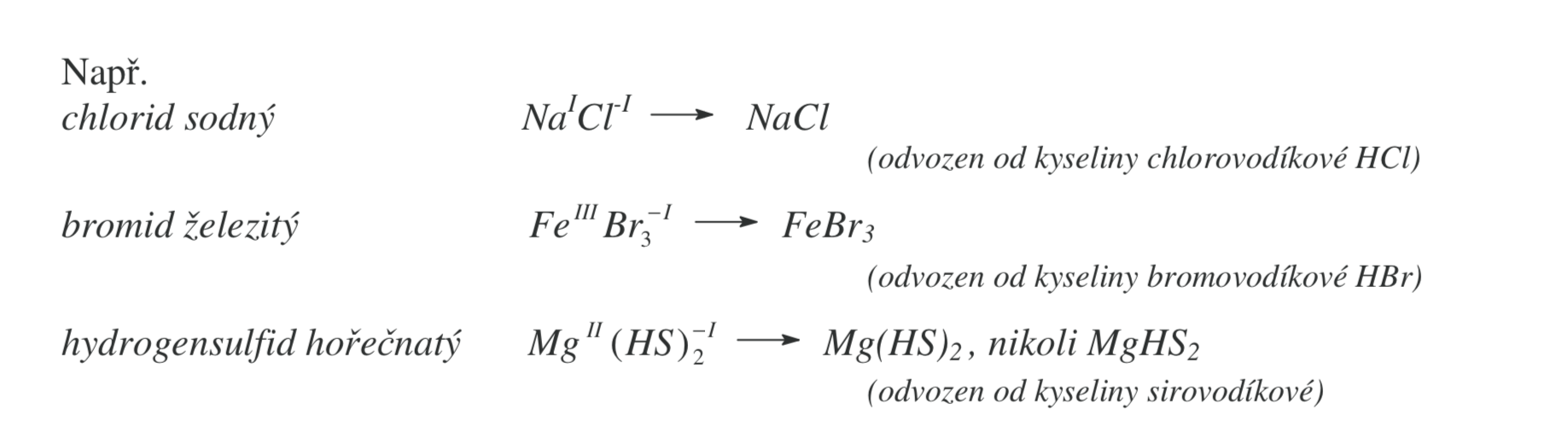 Soli kyslíkatých kyselin
Soli kyslíkatých kyselin
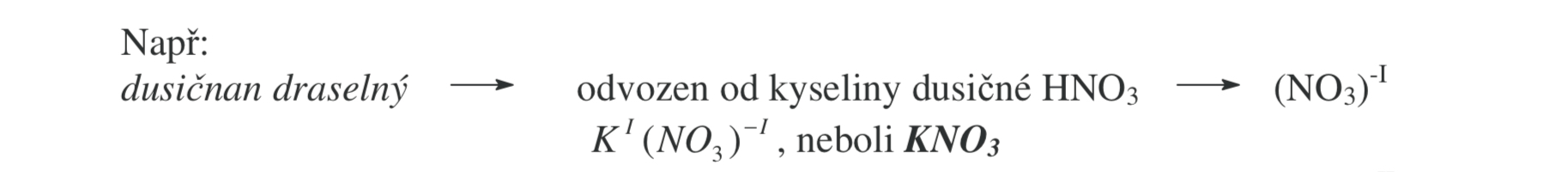
 Hydrogensoli
Hydrogensoli
vzniká, pokud nejsou nahrazeny všechny vodíky
Počet nenahrazených vodíků je vyjádřen před slovem hydrogen (dihydrogen, tetrahydrogen,…)
 Hydráty
HydrátySoli obsahující vázané molekuly vody
 Podvojné soli
Podvojné soli
Obsahují dva anionty nebo dva kationty
Kationty se řadí podle vzrůstající hodnoty oxidačního čísla
Anionty se řadí abecedně


 Knowt
Knowt